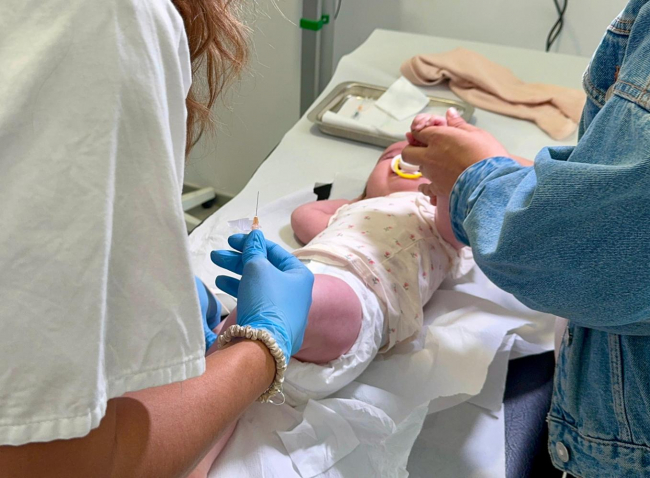
Más del 66% de los pacientes con trastornos mentales grave fuma
"La adicción al tabaco es la gran olvidada entre los pacientes con trastornos mentales"
La consellera de Salud recuerda la importancia de la participación activa de los ciudadanos en el cribado de cáncer de colon
El Programa de cribado de Baleares completará durante este año la invitación a toda la población diana de las islas: 289.460 residentes de entre 50 y 69 años
Atención al Profesional del Servicio de Salud ha contratado a diecisiete facultativos especialistas y dieciséis enfermeras
La Unidad se crea con el objetivo de atraer, acoger, fidelizar y favorecer el desarrollo del capital humano de las categorías más deficitarias

-
 Medio Natural inicia el procedimiento para renovar los instrumentos de gestión del Parque Nacional Marítimo-Terrestre del Archipiélago de Cabrera
Medio Natural inicia el procedimiento para renovar los instrumentos de gestión del Parque Nacional Marítimo-Terrestre del Archipiélago de Cabrera
-
 PIMEM y la Plataforma Contra la Morosidad confían en el Reglamento Europeo para acabar con la injusticia de que los subcontratistas cobren a 99 días
PIMEM y la Plataforma Contra la Morosidad confían en el Reglamento Europeo para acabar con la injusticia de que los subcontratistas cobren a 99 días
-
 Paquete de medidas con el objetivo de que el exceso de burocracia deje de ser un obstáculo para los ciudadanos y disponer de una Administración ágil y eficaz
Paquete de medidas con el objetivo de que el exceso de burocracia deje de ser un obstáculo para los ciudadanos y disponer de una Administración ágil y eficaz
-
 El PSIB-PSOE espera que el decreto de 'depredació administrativa' no facilite la legalización de Sa Vinya en Andratx o el suelo rústico del caso Campos
El PSIB-PSOE espera que el decreto de 'depredació administrativa' no facilite la legalización de Sa Vinya en Andratx o el suelo rústico del caso Campos
-
 Se intensifican los dispositivos para prevenir los delitos contra la salud pública en diversos barrios de Palma
Se intensifican los dispositivos para prevenir los delitos contra la salud pública en diversos barrios de Palma
-
 El Palma International Boat Show incrementa el número de participantes con 295 expositores en su 40.ª edición
El Palma International Boat Show incrementa el número de participantes con 295 expositores en su 40.ª edición
-
 El Consell de Mallorca organiza toda una serie de actividades para celebrar la diada de Sant Jordi
El Consell de Mallorca organiza toda una serie de actividades para celebrar la diada de Sant Jordi
-
 El Hospital General recupera los programas de ictus y ortogeriatría
El Hospital General recupera los programas de ictus y ortogeriatría
-
 La Policía Nacional detiene a una mujer por colocar una baliza en el coche de su ex pareja
La Policía Nacional detiene a una mujer por colocar una baliza en el coche de su ex pareja
-
 El patronato de Impulsa Balears emite una declaración para impulsar la productividad en el archipiélago
El patronato de Impulsa Balears emite una declaración para impulsar la productividad en el archipiélago
-
 El Ajuntament de Marratxí sancionará a dos individuos por abandonar 10 toneladas de restos de obra en la zona de Es Garrovers y Camí de Son Sales
El Ajuntament de Marratxí sancionará a dos individuos por abandonar 10 toneladas de restos de obra en la zona de Es Garrovers y Camí de Son Sales
-
 Los Socialistas piden la comparecencia urgente del presidente del Consell y del conseller de Turismo para dar explicaciones sobre el caso del agroturismo del alto cargo del PP
Los Socialistas piden la comparecencia urgente del presidente del Consell y del conseller de Turismo para dar explicaciones sobre el caso del agroturismo del alto cargo del PP
-
 El PP Balears acusa al PSOE de tratar de confundir y seguir defendiendo los intereses de la ‘trama Koldo’
El PP Balears acusa al PSOE de tratar de confundir y seguir defendiendo los intereses de la ‘trama Koldo’
-
Nuevas ayudas para ayuntamientos para aplicar la ley de bienestar animal y la limpieza de caminos municipales por valor de 500.000 euros
-
 PSIB PSOE, el PI i MÉS per Andratx piden explicaciones sobre los procedimientos en la construcción de los parkings del calle Galicia y calle Cataluña
PSIB PSOE, el PI i MÉS per Andratx piden explicaciones sobre los procedimientos en la construcción de los parkings del calle Galicia y calle Cataluña
-
Los centros de primaria tienen 30 días para adherirse al Plan Piloto Voluntario de Libre Elección de Lengua
-
 Prohens participa en la prueba del nuevo sistema de alertas a la población en caso de emergencia extraordinaria o catástrofe
Prohens participa en la prueba del nuevo sistema de alertas a la población en caso de emergencia extraordinaria o catástrofe
-
 El sector agrario y ganadero de las Illes Balears recibirá 2,96 millones de euros
El sector agrario y ganadero de las Illes Balears recibirá 2,96 millones de euros
-
 El Govern resuelve el sexto pago de las ayudas al alquiler de vivienda de 2022, de 653.000 euros a casi 300 personas beneficiarias
El Govern resuelve el sexto pago de las ayudas al alquiler de vivienda de 2022, de 653.000 euros a casi 300 personas beneficiarias
-
 La Policía Nacional detiene a un varón por un delito de allanamiento de morada y otro de acoso hacia dos vecinas de la misma finca
La Policía Nacional detiene a un varón por un delito de allanamiento de morada y otro de acoso hacia dos vecinas de la misma finca
VEA MÁS NOTICIAS |
|
- Contacto
- www.noticiasmallorca.es
- publicidad@noticiasmallorca.es
- Tarifas Publicidad

Copyright © noticiasmallorca.es es una marca registrada. Todos los derechos reservados.